Have any questions?
+44 1234 567 890
Einführung in die moderne Säurebasen Medizin
Säurebasenbiochemie ist faszinierend unter anderem auch deshalb, weil unterschiedlichste Physiologien interdisziplinär hier vereint werden. Dabei nimmt die angewandte Biochemiefür den Säurebasenhaushalt eine Schlüsselposition ein. Dank Schnittstellen mit dem Redoxsystem liefert die Venöse Bluttitration nicht nur Hinweise auf allfällige Basenmangel wie auch -überschuss, sondern auch bezüglich der Sauerstoffverwertung und dem oxidativen Stress.
Der lokale pH beeinflusst die Bioverfügbarkeit von Sauerstoff, Durchlässigkeit von Zellmembranen, Elektrolyten- & Molekülverteilung (cellular trapping), Wasser-/Fettlöslichkeit, Struktur von Bindegewebe, Wasserbindungsfähigkeit der extrazellulären Matrixproteine sowie Struktur und Funktion von Proteinen. Damit wird auch Enzymaktivität mitgesteuert! Bei der Mehrzahl unserer Stoffwechselreaktionen werden Protonen übertragen, wobei die Tendenz besteht, das Milieu anzusäuern. Alleine dadurch würde sich das Leben selbständig vernichten, wäre es nicht mit ausreichenden Gegenmassnahmen, nämlich Puffer- und Säure-Ausscheidungsmechanismen, ausgerüstet.
Definitionsgemäss geht nach der Dissoziation aus einer Säure die konjugierte Base hervor. In physiologischen pH konstanten Systemen hingegen stiftet diese Aussage eher Verwirrung. Je nach Hydroniumaktivität wird sich eine Säure auch nach der Deprotonisierung weiterhin azidotisch verhalten, weil sie in dem pH Milieu, in dem das Proton abgegeben wurde, konsequenterweise nicht in der Lage sein wird, einen Protonen wieder aufzunehmen.
Diese Überlegung leitet zu einer differenzierten Betrachtungsweise, bei der die landläufige chemische von einer neuen funktionellen Definition abgegrenzt werden muss.
Säuren (dissoziiert)
- nehmen keine Protonen auf.
- geben keine Elektronen ab.
Basen (protonisiert)
- geben keine Protonen ab.
- nehmen keine Elektronen auf.
In Analogie dazu muss bspw. das Laktat, die Base der Milchsäure, im Blut bei einem pH von 7.4 immer noch als Säure angesehen werden, denn in diesem Milieu wird das Molekül keinen Proton aufnehmen. Das Laktat vermindert durch das Gesetz der Elektroneutralität die Konzentration von weniger sauren Anionen wie das Bicarbonat, was metabolisch azidotisch wirkt. Die einzige Situation, in der das Laktat tatsächlich die Bezeichnung einer Base verdient, ist im Cori Zyklus der Leber, bei der aus Laktat Glucose unter der Aufnahme von zwei Protonen regeneriert wird.
Basen / Bicarbonat
Die Bezeichnung des regulatorisch eminent wichtigen Bicarbonats als die "konjugierte Base" der Kohlensäure ist ein weiterer Stolperstein im Verständnis des SBHes. Vergleicht man die Kohlensäure mit Natriumbicarbonat, wurden lediglich Kationen ausgetauscht, nämlich ein Wasserstoff- durch ein Natrium-Ion. Das Bicarbonat ist in beiden Molekülen identisch! Aus dieser Überlegung kann die basische Wirkung alleine niemals dem Bicarbonat sondern muss dem Natrium entspringen (Alkalimetall). Wiederum aus Gründen der Elektroneutralität verdrängt das Natrium überschüssige positiv geladene Protonen, was einer Entsäuerung gleichkommt.
Kohlensäure oben und Bicarbonat unten. Beachten Sie, dass das Natrium darüber entscheidet, ob das Molekül basisch oder sauer ist.
In Analogie dazu sind negativ geladene Ionen und Moleküle sauer, wie z.B. Chlor, Schwefel, Phosphor, Fluor und Iod. Durch das Kombinieren von sauer und basisch wirkenden Elementen werden sie neutral: Natrium als extrem starke Base (Natronlauge) zusammen mit Chlor als äusserst heftige Säure (Salzsäure) ergeben gemeinsam das neutrale Kochsalz (Kochsalz in Lösung ist eigentlich nicht neutral sondern sauer(!) da das Chlor sauerer ist als das Natrium basisch.)
pH Regulation des Blutes
Immer wieder bekommen wir zu hören, wie unser Blut-pH peinlich genau eingestellt werden müsse. Dieser Fehleinschätzung verdanken wir Haselbalch mit seiner mathematischen Logarithmisierung der H3O+ Konzentration. Logarithmen eigenen sich hervorragend, riesige Zahlenbereiche zu komprimieren. Auf diese Weise erhalten wir aber auch ein verzerrtes Bild der Normbereiche.
Die Regulation des pH Wertes erfolgt mit Hilfe von Puffersystemen, die sich aus verschiedensten basischen Substanzen mit ihren konjugierten Säuren zusammensetzen. Es sind dies vor allem Phosphate, Eiweisse und der Blutfarbstoff Hämoglobin. Das Bicarbonat kann mit seinem pKs von 6.1 bei einem pH von 7.45 kaum als Puffer wirken und schützt uns damit vielmehr gegen eine Alkalose als vor einer Azidose. Bicarbonat wirkt deshalb nicht als eigentlicher Puffer sondern seine Aufgabe liegt vielmehr im auswärts gerichteten Transport des Kohlendioxyds
Entsäuerung und Stoffwechsel
Ein gesunder Stoffwechsel mit einem hohen Wirkungsgrad erbringt ein Maximum an Leistung bei einem Minimum an ausscheidungspflichtigen Substanzen. Dieser Anspruch wird durch die aerobe Energiegewinnung erfüllt, vergleicht man die gerade zu 2 ATP Moleküle als Ausbeute eines Glukosemoleküls unter Ausschluss von Sauerstoff, mit den 38 ATP Molekülen bei optimalen aeroben Bedingungen.
Sauerstoff ist im Plasma sehr schlecht löslich. Dank dem Hämoglobin steigt die Transportfähigkeit auf gewaltige 200ml Sauerstoff pro Liter Blut bzw. pro 400ml Hämoglobin. Würde das Hämoglobin sein gefährliches Gut "abstossen" wären fatale Luftembolien die Folge. Statt dessen muss Sauerstoff vom Gewebe aus dem Hb "geholt" werden.
Die Affinität zum Sauerstoff ist gemäss der Sauerstoffdissoziationskurve (SDK) verschiedenen Parametern unterworfen. Sie nimmt mit zunehmender Ansäuerung, Temperatur und pCO2 in der Endstrombahn ab (Rechtsverschiebung der SDK, Bohr-Haldane-Effekt). Analog dazu sprechen wir im umgekehrten Fall von einer Linksverschiebung. Damit könnte theoretisch (und praktisch?) eine unkontrollierte Entsäuerung die Sauerstoffabgabe an das Gewebe erschweren und den Stoffwechsel in die Anaerobie verlagern. Dies hätte aber selber den homöostatischen Effekt, dass die Alkalose durch mehr Gärung aufgehoben würde.
Auswirkung des Stoffwechsels auf unsere Blutpuffer
Der Abbau von Glucose unter aeroben Bedingungen führt zu den Endprodukten CO2 und H2O. Das CO2 diffundiert rasch zu den Erythrozyten wo es teils gebunden wird und teils unter der Einwirkung der zinkabhängigen Carboanhydrase zu Kohlensäure transformiert wird. Kohlensäure dissoziiert sofort zu Bicarbonat und das freigesetzte Proton liefert durch dessen Bindung dem Hämoglobin den Impuls, Sauerstoff abzugeben. Die Aufnahme des Protons senkt konsequenterweise die Pufferkapazität des Hämoglobins. Das Bicarbonat wird aus dem Erythrozyten in Austausch für ein Chlorid an das Plasma abgegeben, damit die sauren Verhältnisse und damit die erleichterte Sauerstoffabgabe im Ec aufrecht erhalten bleiben. Mit anderen Worten bedeutet die Sauerstoffabgabe (aerober Stoffwechsel) eine Ansäuerung des Erythrozyten bei gleichzeitiger Alkalisierung des Plasmas. Beim anaeroben Stoffwechsel geschieht das Gegenteil: Das Plasma wird durch die Laktatproduktion angesäuert, das Hämoglobin behält seinen Sauerstoff und damit auch eine hohe Pufferkapazität.
Die Venöse Bluttitration
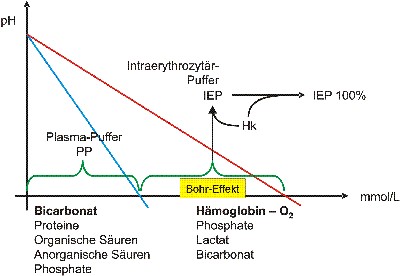
Der Abstand der Schnittpunkte der Plasma- und Vollbluttitrationskurven ist ein Mass für den Bohr-Effekt, was wiederum nur durch den Einbezug des Hämatokrites standardisierbar und reproduzierbar wird (Intraerythrozytäre Pufferkapazität IEP bzw. IEP100%Hk).
Wie bereits geschildert, wird ein aktiver aerober Stoffwechsel die IEP senken und gleichzeitig das Plasma-Bicarbonat anheben. Bei zunehmendem anaeroben Stoffwechsel treffen wir sinngemäss umgekehrte Verhältnisse an. Dies ermöglicht uns erstmals einen Einblick in die Sauerstoffverwertung der Zelle (Mitochondriale Aktivität).
Hypothese
Je höher die mitochondriale Aktivität, um so aerober aber auch tendenziell entzündlicher, oxidativer und saurer in der Zelle, je niedriger, um so anaerober, degenerativer, tendenziell reduktiver der Stoffwechsel und damit auch basischer in der Zelle.